9月19日,貝達藥業和C4 Therapeutics, Inc. (C4T)合作開發的CFT8919膠囊獲得國家藥品監督管理局簽發的《藥物臨床試驗批準通知書》(通知書編號:2024LP02116、2024LP02117),擬用于攜帶 EGFR 突變的非小細胞肺癌(NSCLC)患者。
CFT8919是一種具有口服生物利用度的變構 BiDAC? (雙功能蛋白)降解劑,在臨床前研究中,CFT8919在EGFR L858R驅動的NSCLC的體內外模型中具有活性,可靶向廣泛的在靶耐藥突變并有顱內活性,具有預防或治療患者腦轉移的潛力。CFT8919通過與L858R突變的變構位點結合,展示出良好的選擇性,同時對像T790M或C797S突變的EGFR繼發耐藥突變有效。2023年,CFT8919片獲得美國FDA臨床試驗(IND)許可。
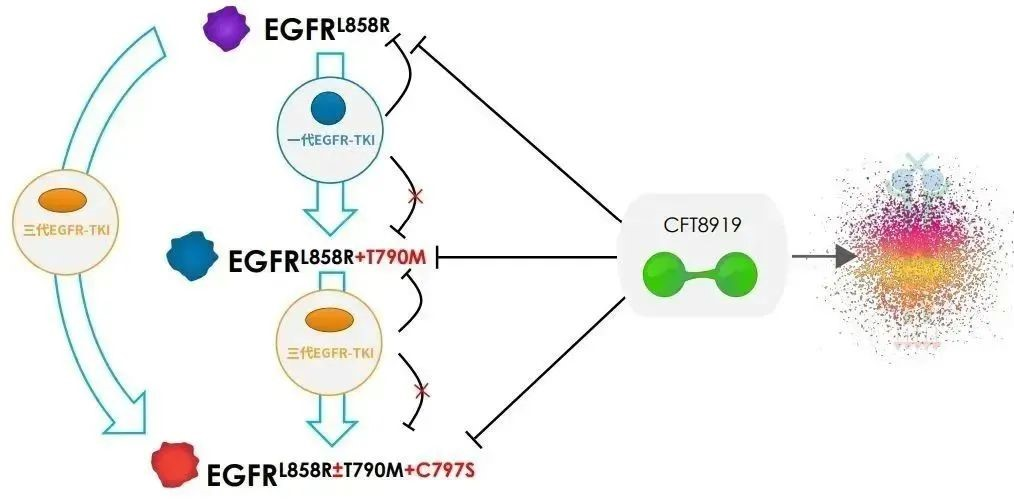
△CFT8919作用機理圖(來源:C4T)
多個大型隨機對照試驗亞組分析結果顯示,一代、二代和三代EGFR-TKI治療19del和21L858R突變患者顯示出了不同的療效,總體來看,19del突變患者的獲益要明顯高于21L858R突變的患者。對于攜帶21L858R突變NSCLC患者,臨床上仍存在較大的未滿足需求,期待更好的治療方案。
貝達藥業副總裁、項目總負責人王三虎表示:
很高興看到CFT8919膠囊獲批開展臨床,這是本項目開發過程中的一個重要里程碑,貝達和C4T雙方項目團隊將繼續攜手同行,共同努力,積極推進臨床研究,期待CFT8919膠囊能早日獲批上市,給患者帶來新的治療選擇。
貝達藥業董事長丁列明博士表示:
貝達通過自主研發和戰略合作相結合的方式豐富公司產品管線,CFT8919是公司在肺癌治療領域引進的重點項目,是在靶向蛋白降解領域的一次全新探索。未來,貝達將繼續立足民生需求,深耕新藥研發領域,力爭研制出更多的新藥、好藥,提高藥物可及性,造福廣大患者。
下一條: 泰瑞西利二線研究期中分析數據亮相2024 ESMO
