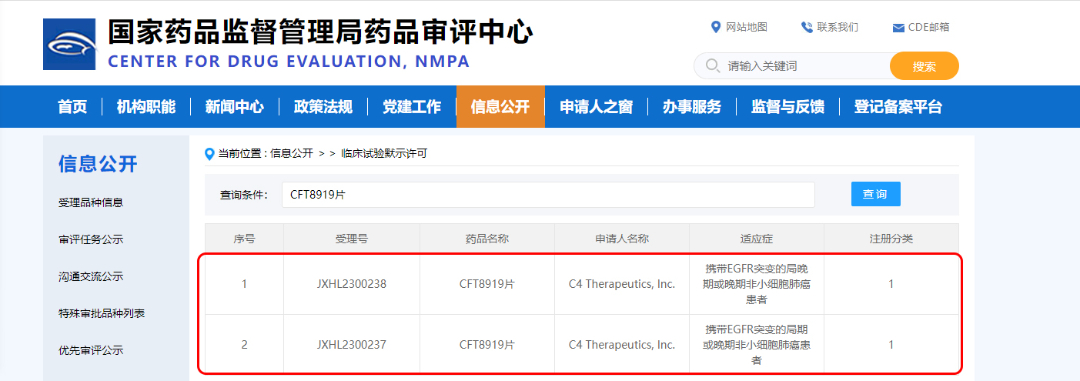
12月4日,貝達藥業從C4 Therapeutics, Inc. (C4T)引進的CFT8919片(擬用于攜帶EGFR突變的非小細胞肺癌)臨床試驗申請收到國家藥品監督管理局簽發的《藥物臨床試驗批準通知書》(通知書編號:2023LP02450;2023LP02451)。今年7月,C4T宣布其申報的CFT8919片藥品臨床試驗申請已獲美國食品藥品監督管理局批準。
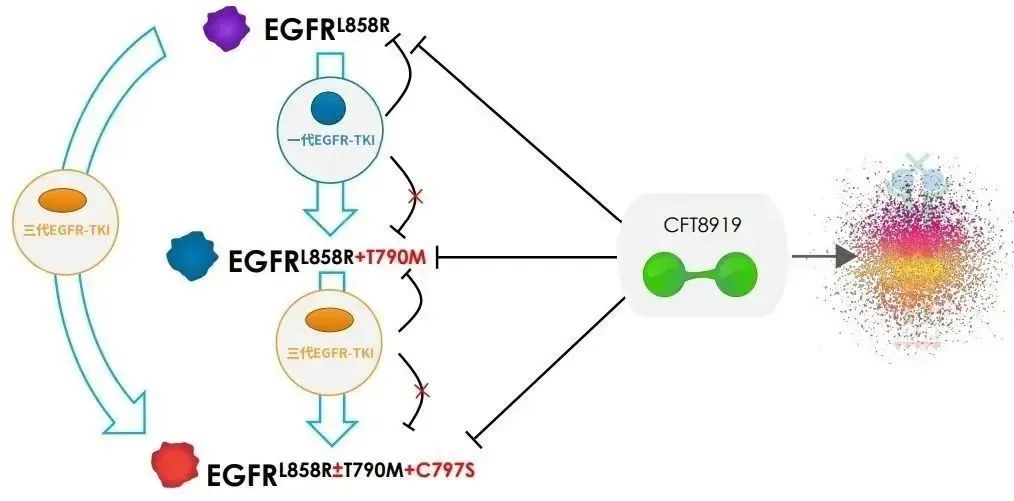
△CFT8919作用機理圖(來源:C4T)
CFT8919片是一種具有口服生物利用度的變構 BiDAC? 降解劑。CFT8919在EGFR L858R驅動的NSCLC的體外和體內模型中具有活性,可靶向EGFR繼發性耐藥突變,并且具有顱內活性,具有預防或治療患者腦轉移的潛力。
CFT8919通過與L858R突變的變構位點結合,展示出良好的選擇性,同時對T790M或C797S突變的EGFR繼發耐藥突變有效。此外,CFT8919對攜帶L858R單突變和奧希替尼、厄洛替尼耐藥后產生的L858R繼發耐藥突變,均具有很好細胞增殖抑制活性,同時展示出良好的EGFR野生型選擇性。
貝達藥業副總裁、項目總負責人王三虎表示,已獲批上市的EGFR-TKIs治療EGFR L858R突變的獲益有限,對三代EGFR-TKIs治療失敗或一/二代EGFR-TKIs治療失敗再次活檢T790M陰性的患者也缺乏有效的治療選擇,這一治療需求亟待滿足,很高興看到CFT8919片獲批臨床,也預示著我們為這一部分肺癌患者帶來有效的治療選擇又近了一步。
貝達藥業董事長丁列明表示,貝達藥業自成立至今,一直致力于創新藥物的開發,為更多患者帶來高質量、可及的藥物,滿足肺癌等領域迫切的臨床需求。CFT8919片具有重要的臨床開發價值,期待CFT8919片隨著進一步的研究和開發,能夠成為肺癌治療領域的重要突破,為全球患者提供新的治療選擇,改善患者的生活質量。
下一條: 鹽酸恩沙替尼榮獲2022年度浙江省科學技術進步一等獎
