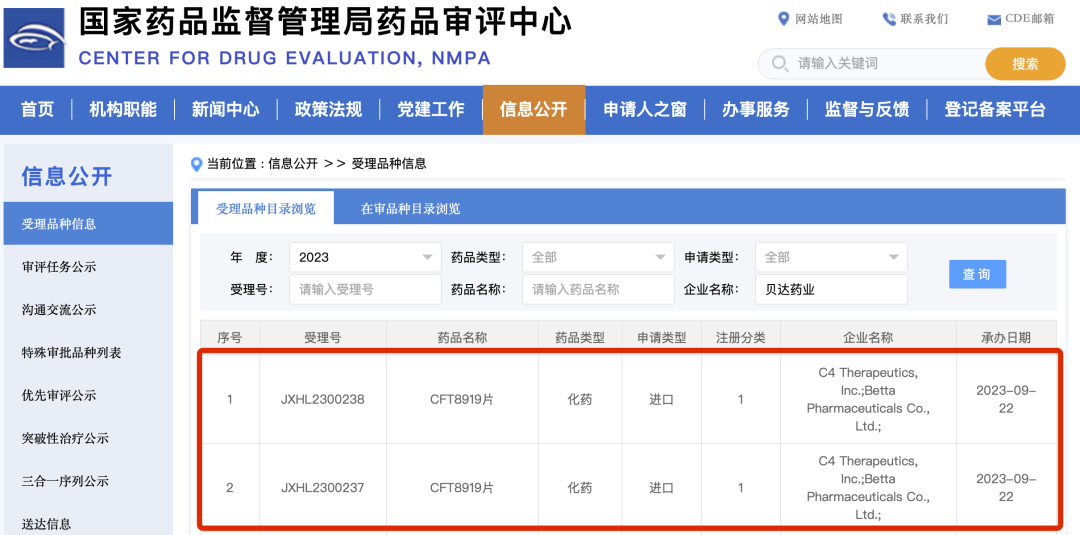
近日,貝達藥業收到國家藥品監督管理局簽發的《受理通知書》(受理號:JXHL2300237、JXHL2300238),公司從C4 Therapeutics, Inc. (C4T)引進的CFT8919片攜帶EGFR突變的非小細胞肺癌患者適應癥臨床試驗申請獲國家藥品監督管理局受理。
今年7月,C4T收到了美國食品藥品監督管理局簽發的《藥物臨床試驗批準通知書》,允許CFT8919片在美國開展Ⅰ/Ⅱ期臨床試驗。CFT8919片是公司從C4T引進的一種具有口服生物利用度的變構 BiDAC? 降解劑,對攜帶EGFR外顯子21(L858R)突變具有良好的活性和選擇性,同時對T790M或C797S突變的EGFR繼發耐藥突變有效。
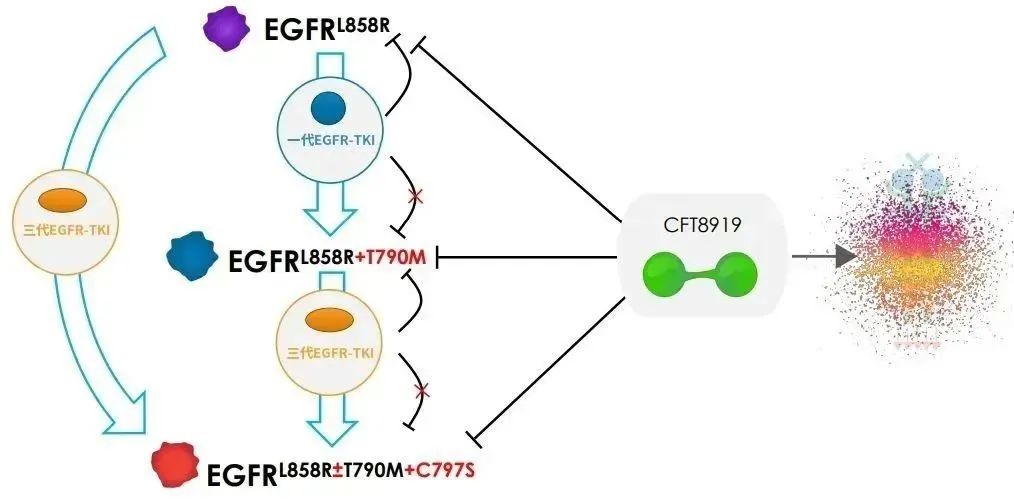
△CFT8919作用機理圖(來源:C4T)
多個大型隨機對照試驗亞組分析結果顯示,一代、二代和三代EGFR-TKI治療19del和21L858R突變患者顯示出了不同的療效,總體來看,19del突變患者的獲益要明顯高于21L858R突變的患者。對于攜帶21L858R突變NSCLC患者,臨床上仍存在較大的未滿足需求,期待更好的治療方案。
貝達藥業副總裁、項目總負責人王三虎表示,臨床前研究中,CFT8919片在EGFR L858R 驅動的NSCLC 的體內外模型中具有活性,可靶向廣泛的在靶耐藥突變并有顱內活性,具有預防或治療患者腦轉移的潛力。貝達從C4T 引進的CFT8919片能為EGFR L858R 突變患者提供嶄新的治療選擇,造福廣大患者。
貝達藥業董事長丁列明表示,CFT8919片是公司在靶向蛋白降解領域的一次探索,公司已有一代、三代EGFR-TKIs上市產品,以及四代EGFR-TKIs、EGFR/cMET雙抗產品管線,在EGFR突變的非小細胞肺癌領域積累了豐富的經驗,為助力CFT8919片后續研發奠定了堅實基礎。亞洲EGFR L858R突變患病人群較多,存在較大的未被滿足的臨床用藥需求。期待CFT8919片早日開展臨床研究,為全球患者提供新的治療選擇。
下一條: 中央統戰部副部長、國僑辦主任陳旭一行調研貝達藥業
